Tin tứcNgày: 09-09-2020 bởi: Mã Thị Vân
Nước cứng ảnh hưởng như thế nào đến cuộc sống của bạn? Hiểu sâu hơn về nước cứng
1. Khái niệm
Nước cứng là nước chứa hàm lượng lớn chất khoáng hòa tan ( có tính chất trái ngược với nước mềm). Khi nước đầu nguồn chảy qua các loại đá vôi, đá phấn hay thạch cao, tạo nên nước cứng mang lượng lớn canxi và magie cacbonat, bicacbonat và sunfat.

Trong nước cứng cũng có thể chứa các ion sắt khi bị oxi hóa, những ion này sẽ xuất hiện dưới dạng vết ố nâu đỏ trên bề mặt vật liệu tráng men hoặc vải sợi. Ngoài ra, những ion kim loại khác như stronti, nhôm, bari, mangan, kẽm cũng có thể gây ra hiện tượng nước cứng, nhưng vì hàm lượng trong nước của những ion này thường rất thấp nên xem như không đáng kể.
Độ cứng của nước được đo bằng nồng độ các cation hóa trị cao trong nước. Các cation hóa trị cao là những phức chất kim loại mang điện tích dương với hóa trị lớn hơn 1. Thông thường, các cation sẽ mang hóa trị là 2. Các cation phổ biến được tìm thấy trong nước cứng bao gồm Ca2 và Mg2. Các ion kim loại này xâm nhập vào nước nguồn, rửa trôi các khoáng chất trong tầng ngậm nước. Khoáng chất chứa canxi phổ biến là CaCO3 và thạch cao. Khoáng chất magie phổ biến là dolomit (cũng chứa canxi). Nước mưa và nước cất là nước mềm vì chúng chứa ít ion.
2. Tác hại của nước cứng
*Trong sinh hoạt
Nước cứng làm giảm khả năng tạo bọt của xà phòng, đồng thời làm giảm tác dụng tẩy rửa do tạo muối canxi không tan. Tuy nhiên, khi sử dụng trong nước cứng, ion stearat sẽ phản ứng kết hợp với ion canxi hoặc magie tạo thành hợp chất tủa không tan, canxi stearat, thường được gọi là "váng bọt xà phòng" (Soap scum). Những váng bọt này khi bám trên quần áo sẽ khó tẩy sạch, đồng thời làm giảm độ bền quần áo và vải sợi.
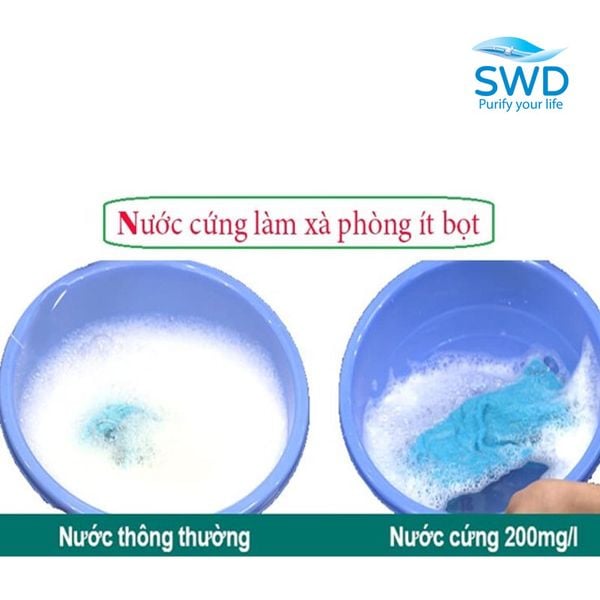
Do đó, độ cứng có thể được định nghĩa là khả năng hòa tan xà phòng của một mẫu nước, hoặc khả năng kết tủa của xà phòng trong mẫu nước do nước cứng có tính đặc trưng là ngăn cản sự đông đặc của xà phòng. Các chất tẩy rửa tổng hợp sẽ không tạo thành váng như vậy.
Đối với các đồ dùng trong nhà bếp để đun nấu như bình nấu nước hoặc bình nóng lạnh, CaCO3 tạo ra khi đun sôi nước, gây cặn, làm giảm khả năng dẫn và truyền nhiệt, tiêu hao điện năng, gây lãng phí, đồng thời nhanh làm hỏng sản phẩm. Nước cứng cũng không dùng để pha chế thuốc vì có thể gây kết tủa làm thay đổi thành phần của thuốc. Khi dùng nước cứng nấu làm rau, đậu, thịt khó chín, làm mất vị và màu sắc thực phẩm.

Cặn do nước cứng có thể làm tắc đường ống dẫn nước. Những cặn này chủ yếu là canxi cacbonat (CaCO3), magie hydroxit (Mg (OH) 2) và canxi sunfat (CaSO4). Cacbonat canxi và magiê có xu hướng kết tủa thành chất rắn màu trắng đục trong của đường ống và bộ trao đổi nhiệt. Sự kết tủa này (hình thành chất rắn không hòa tan) thường là do sự phân hủy nhiệt của các ion bicacbonat nhưng cũng có thể xảy ra ở nồng độ bão hòa. Sự tích tụ của cặn sẽ làm hạn chế dòng chảy. Trong nồi hơi, cặn lắng làm giảm nhiệt vào nước, giảm hiệu suất gia nhiệt, khiến các bộ phận kim loại bị quá nóng. Trong hệ thống điều áp, hiện tượng quá nóng này có thể dẫn đến hỏng nồi hơi. Thiệt hại do cặn canxi cacbonat tùy vào dạng tinh thể, ví dụ, canxit hoặc aragonit.
*Đối với sức khỏe
Vào thập niên 1970, người ta phát hiện tỉ lệ mắc bệnh tim mạch của người dân ở những vùng sử dụng nước mềm cao hơn so với tỉ lệ của những người ở khu vực sử dụng nước cứng. Nhiều nghiên cứu được thực hiện ở Hoa Kỳ, Canada, và Châu Âu, để tìm ra mối quan hệ giữa ảnh hưởng của nước cứng trong sinh hoạt đối với những bệnh tim mạch. Tuy những nghiên cứu này chỉ mới ở giai đoạn sơ bộ và chưa hoàn thiện, người ta đưa ra giả thiết rằng những nguyên tố như canxi, magie, mangan, trong nước cứng có tác dụng ngăn ngừa nguyên nhân gây bệnh tim mạch. Nhưng chúng lại ảnh hưởng đến da và tóc, khiến tóc bạn bị khô và sơ hơn.
Nhiều nghiên cứu sau đó chỉ ra rằng nước cứng không những không có hại cho sức khỏe con người mà ngược lại, còn có một số lợi ích nhờ vào các nguyên tố canxi và magie có trong nước cứng. Nước cứng được xem là nguồn cung cấp hai nguyên tố này cho cơ thể con người.
Theo Tổ chức Y tế Thế giới (WHO), canxi và magie là những nguyên tố thiết yếu và có lợi ích đối với con người. Việc thiếu hụt những nguyên tố này trong khẩu phần dinh dưỡng sẽ dẫn đến nhiều vấn đề về sức khỏe. Ví dụ, việc thiếu hụt hấp thu canxi sẽ dễ dẫn đến các bệnh như ung thư dạ dày, loãng xương, sỏi thận, ung thư đại tràng, cao huyết áp, đột quỵ, bệnh động mạch vành.
Nguyên tố magie là loại cation nhiều thứ tư trong cơ thể con người và nhiều thứ hai trong các dịch nội bào. Nguyên tố magie được cho là yếu tố có lợi chính trong nước cứng. Việc thiếu hụt magie sẽ dễ dẫn đến các bệnh như cao huyết áp, bệnh động mạch vành, giảm hấp thụ insulin, tiểu đường, ung thư thực quản, ung thư buồng trứng. Một số nghiên cứu khuyến cáo nồng độ tối ưu trong nước uống của nguyên tố canxi là 40–80 ppm và magie là 20–30 ppm; còn độ cứng toàn phần trong nước tối ưu là 2–4 mmol/L (tương đương 200–400 ppm).
*Trong công nghiệp
Uống nước cứng có thể đem lại một số lợi ích cho sức khỏe nhưng đối với ngành công nghiệp, nước cứng lại là vấn đề nan giải. Vì chúng bám cặn, dần dần có thể gây áp lực làm nổ nồi hơi, hỏng hóc tháp giải nhiệt cũng như các thiết bị xử lý nước khác.
Trong bể bơi, nước cứng thường có màu nước đục (trắng đục). Do canxi và magie hydroxit đều hòa tan trong nước. Độ tan của các hiđroxit kim loại kiềm thổ mà canxi và magie thuộc (nhóm 2 của bảng tuần hoàn) tăng dần khi di chuyển xuống dưới bảng tuần hoàn. Nước hòa tan các hidroxit kim loại hấp thụ khí cacbonic từ không khí, tạo thành các muối cacbonat không tan, làm tăng độ đục. Điều này thường là do độ pH quá cao (pH> 7,6). Do đó, một giải pháp chung là duy trì nồng độ clo ở mức thích hợp, giảm độ pH bằng cách thêm axit clohydric tối ưu từ 7,2 đến 7,6.
3. Các loại nước cứng
Nước cứng có 3 loại:
- Nước cứng tạm thời: Là một loại nước cứng có chất bicacbonat hòa tan (canxi bicacbonat và magie bicacbonat). Khi bị hòa tan, loại chất này tạo ra cation canxi và magiê (Ca2 +, Mg2 +) cùng anion cacbonat và bicacbonat (CO2−3 và HCO3). Sự có mặt của các cation kim loại là nguyên nhân tạo nên nước cứng.
Cách khắc phục: không giống như độ cứng vĩnh viễn do các hợp chất sunfat và clorua gây ra, nước cứng tạm thời có thể được giảm độ cứng bằng cách đun sôi nước, hoặc thêm vôi (canxi hydroxit). Đun sôi thúc đẩy sự hình thành cacbonat từ bicacbonat, đẩy canxi cacbonat ra khỏi dung dịch, khiến nước mềm hơn khi để nguội
- Nước cứng vĩnh cửu: Độ cứng vĩnh cửu, hay còn gọi là độ cứng phi cacbonat, gây ra do sự có mặt của các muối clorua và sunfat như CaCl2, CaSO4, MgCl2, MgSO4
Cách khắc phục: Thường khó làm mềm bằng cách đun sôi. Trong loại nước này thường chứa canxi sunfat / canxi clorua hoặc magie sunfat / magie clorua. Đây là các chất không bị đẩy ra ngoài khi nhiệt độ tăng. Các ion gây cứng nước vĩnh viễn sẽ được loại bỏ bằng máy làm mềm hoặc cột trao đổi ion.
Độ cứng vĩnh viễn = độ cứng vĩnh viễn của canxi + độ cứng vĩnh viễn của magie.
- Nước cứng toàn phần
Độ cứng toàn phần, hay còn gọi là "độ cứng tổng", bằng tổng hàm lượng toàn bộ các ion canxi và magie có trong dung dịch, được thể hiện dưới hàm lượng tương đương của CaCO3. Nói cách khác, độ cứng toàn phần bằng giá trị độ cứng tạm thời và độ cứng vĩnh cửu cộng lại. Độ cứng tạm thời được tính dựa trên hàm lượng ion hidro cacbonat, còn độ cứng toàn phần được tính dựa trên hàm lượng ion canxi và magie. Nếu độ cứng tạm thời lớn hơn hoặc bằng độ cứng toàn phần, có thể suy ra giá trị độ cứng vĩnh cửu bằng 0 và độ cứng tạm thời chính là giá trị độ cứng của dung dịch.
4. Cách làm mềm nước cứng
Chúng ta luôn mong muốn làm mềm nước cứng. Nhưng hầu hết các chất tẩy rửa đều chứa các thành phần chống lại tác hại của nước cứng. Vì lý do này, việc làm mềm nước thường không cần thiết. Trong trường hợp bạn cảm thấy quá khó chịu khi nước cứng làm đồ dùng sinh hoạt của bạn bị rỉ, nhanh hỏng, bạn nên làm mềm nước bằng hệ thống máy lọc nước cho gia đình để giảm tình trạng hỏng hóc đồ dùng. Một phương pháp phổ biến làm mềm nước là sử dụng nhựa trao đổi ion, loại nhựa này thay thế các ion như Ca2 + bằng số lượng gấp đôi các đơn chất như ion natri hoặc kali.
Soda tẩy rửa (natri cacbonat, Na2CO3) có thể dễ dàng tìm kiếm và đã được sử dụng từ lâu như một chất làm mềm nước cho đồ giặt trong nhà, kết hợp với xà phòng hoặc chất tẩy rửa thông thường.
5. Cân nhắc về sức khỏe
Tổ chức Y tế Thế giới cho rằng "dường như không có bất kỳ bằng chứng thuyết phục nào cho thấy độ cứng của nước gây ra những ảnh hưởng xấu đến sức khỏe con người". Trên thực tế, Hội đồng Nghiên cứu Quốc gia Hoa Kỳ đã phát hiện nước cứng được đóng vai trò như một loại thực phẩm bổ sung canxi và magiê.
Một số nghiên cứu đã chỉ ra mối quan hệ giữa độ cứng của nước (170 mg canxi cacbonat trên một lít nước) và gia tăng bệnh tim mạch ở nam giới. Nhưng Tổ chức Y tế Thế giới đã xem xét và kết luận dữ liệu không đủ để đưa ra khuyến nghị về mức độ cứng cho người dân.
Một số khuyến nghị được đưa ra về mức tối đa và tối thiểu của canxi (40–80 ppm) và magiê (20–30 ppm) trong nước uống và tổng độ cứng được biểu thị bằng tổng nồng độ canxi và magiê là 2–4 mmol / L.
Các nghiên cứu khác đã chỉ ra mối liên quan yếu giữa sức khỏe tim mạch và độ cứng của nước
Một số nghiên cứu liên quan giữa sử dụng nước cứng với sự gia tăng bệnh chàm ở trẻ em cũng đã được thực hiện.Thử nghiệm điều trị bệnh chàm bằng nước làm mềm được thực hiện vào năm 2008, là một thử nghiệm ngẫu nhiên về chất làm mềm trao đổi ion để điều trị bệnh chàm ở trẻ em,. Tuy nhiên, không có sự khác biệt ý nghĩa trong tiến triển bệnh tật giữa trẻ em được sử dụng máy làm mềm nước tại nhà và những người không có.
6. Đo lường độ cứng trong nước
Độ cứng có thể được đo bằng công cụ chuyên dụng. Tổng độ cứng của nước bằng tổng nồng độ mol của Ca2 + và Mg2 +, tính bằng đơn vị mol / L hoặc mmol / L. Mặc dù độ cứng của nước thường chỉ tính bằng tổng nồng độ của canxi và magiê (hai ion kim loại hóa trị cao phổ biến nhất), tuy nhiên ở 1 số nơi, sắt, nhôm và mangan cũng có thể ở mức cao. Màu nâu gỉ thể hiện cho quá trình vôi hóa của sắt thay vì màu trắng như hầu hết các hợp chất khác.
Độ cứng của nước thường không được biểu thị bằng nồng độ mol mà được biểu thị bằng nhiều đơn vị khác nhau, chẳng hạn như độ cứng chung (đGH), độ Đức (° đH), phần triệu (ppm, mg / L, hoặc độ Mỹ), gam mỗi gallon (gpg), độ Anh (° e, e, hoặc ° Clark) hoặc độ Pháp (° fH, ° f hoặc ° HF; chữ f viết thường được sử dụng để tránh nhầm lẫn với độ F). Bảng dưới đây cho thấy các hệ số chuyển đổi giữa các đơn vị khác nhau.
Các đơn vị khác nhau đại diện cho khối lượng tương đương của canxi oxit (CaO) hoặc canxi cacbonat (CaCO3) khi hòa tan trong một đơn vị thể tích nước tinh khiết sẽ dẫn đến tổng nồng độ mol của Mg2 + và Ca2 + như nhau. Các hệ số chuyển đổi khác nhau xuất phát từ thực tế khối lượng tương đương của canxi oxit và canxi cacbonat cùng đơn vị đo khối lượng và thể tích khác nhau.
Vì trong nước cùng tồn tại nhiều chất khoáng, với độ pH và nhiệt độ khác nhau một số thang đo không thể đưa ra được kết quả chính xác.
Nước biển được coi là nước rất cứng do có lượng muối hòa tan lớn. Thông thường, độ cứng của nước biển là 6,630 ppm (6,63 gam / lít). Ngược lại, nước ngọt có độ cứng trong khoảng 15 đến 375 ppm.
7. Chỉ số
Một số chỉ số được sử dụng để xác định lượng canxi cacbonat trong hỗn hợp nước, dầu hoặc khí.
Chỉ số bão hòa Langelier
Chỉ số bão hòa Langelier (còn được gọi là chỉ số ổn định Langelier) là một con số tính toán độ ổn định canxi cacbonat của nước. Chúng cho biết liệu nước sẽ kết tủa, hòa tan hay ở trạng thái cân bằng với canxi cacbonat. Năm 1936, Wilfred Langelier đã phát triển một phương pháp để dự đoán độ pH để nước bão hòa trong canxi cacbonat (được gọi là pHs).] LSI được biểu thị bằng sự khác biệt giữa pH thực và pH bão hòa:
- Đối với LSI> 0, nước siêu bão hòa và có xu hướng kết tủa một lớp cặn CaCO3.
- Đối với LSI = 0, nước bão hòa (ở trạng thái cân bằng) với CaCO3. Một lớp cặn CaCO3 không bị kết tủa cũng không bị hòa tan.
- Đối với LSI <0, nước ít bão hòa và có xu hướng hòa tan CaCO3 rắn.
Nếu pH thực tế của nước thấp hơn pH bão hòa tính toán, LSI là âm và nước có khả năng đóng cặn rất hạn chế. Nếu độ pH thực tế vượt quá độ pHs, LSI là dương và quá bão hòa với CaCO3, nước có xu hướng đóng cặn. Khi tăng chỉ số dương, khả năng đóng cặn sẽ cao lên.
Trên thực tế, nước có LSI từ −0,5 đến +0,5 không hiển thị rõ đặc tính hòa tan hoặc tạo cặn của khoáng chất. Nước có LSI dưới −0,5 thể hiện khả năng hòa tan cao trong khi nước có LSI trên +0,5 có xu hướng thể hiện đặc tính tạo cặn lớn.
LSI nhạy cảm với nhiệt độ. LSI tăng lên khi nhiệt độ nước tăng lên. Điều này có ý nghĩa quan trọng trong các tình huống sử dụng nước giếng. Nhiệt độ của nước khi lần đầu tiên ra khỏi giếng thường thấp hơn đáng kể so với nhiệt độ bên trong tòa nhà hay tại phòng thí nghiệm sử dụng nước giếng. Sự gia tăng nhiệt độ này có thể gây ra đóng cặn, đặc biệt là trong trường hợp của máy nước nóng. Ngược lại, các hệ thống làm giảm nhiệt độ nước sẽ ít bị đóng cặn hơn.
Chỉ số ổn định Ryznar
Chỉ số ổn định Ryznar (RSI) sử dụng dữ liệu quy mô hệ thống nước thành phố để dự đoán tác động hóa học của nước. Chỉ số ổn định Ryznar (RSI) được phát triển từ các quan sát thực nghiệm về tốc độ ăn mòn và sự hình thành màng của lưới thép. Có công thức là:
- Đối với 6,5 <RSI <7 nước xấp xỉ ở trạng thái cân bằng bão hòa với canxi cacbonat
- Đối với RSI> 8, nước ở trạng thái bão hòa và do đó, sẽ có xu hướng hòa tan mọi CaCO3 rắn hiện có
- Đối với RSI <6,5 nước có xu hướng ở dạng cặn
Puckorius Scaling Index (PSI) Chỉ số tỷ lệ Puckorius (PSI)
Chỉ số tỷ lệ Puckorius (PSI) sử dụng các thông số hơi khác nhau để định lượng mối quan hệ giữa trạng thái bão hòa của nước và lượng cặn.
Các hệ số đo khác
Các chỉ số khác bao gồm Chỉ số Larson-Skold, Chỉ số Stiff-Davis và Chỉ số Oddo-Tomson.
Nước trên thế giới
Độ cứng của nguồn nước địa phương phụ thuộc vào nguồn nước ngầm. Nước ở các suối chảy qua đá núi lửa (macma) sẽ mềm, trong khi nước từ các lỗ khoan vào đá xốp thường rất cứng.